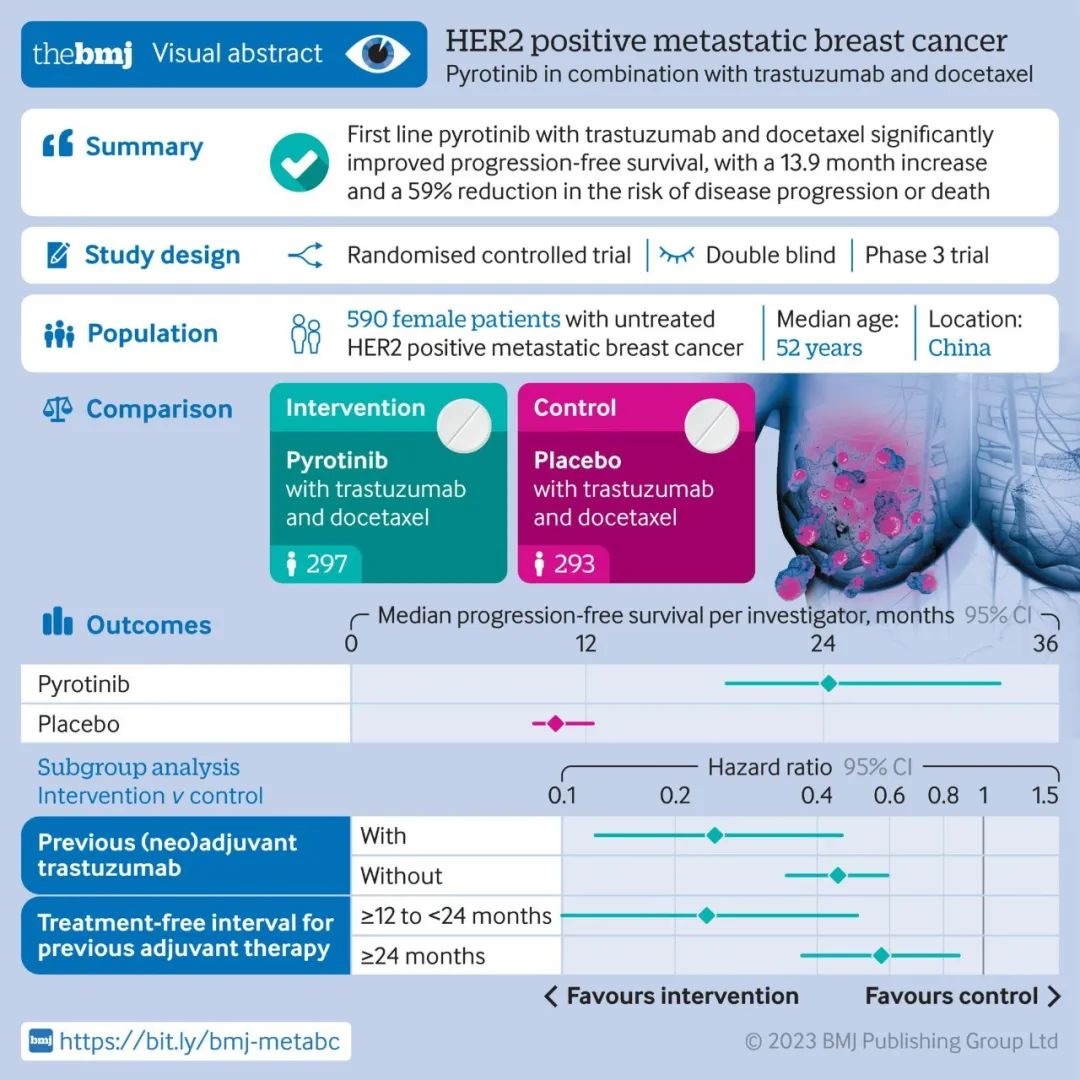
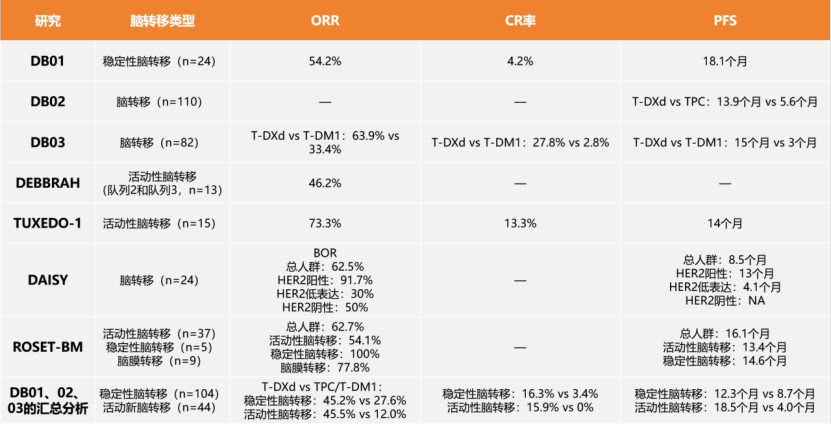
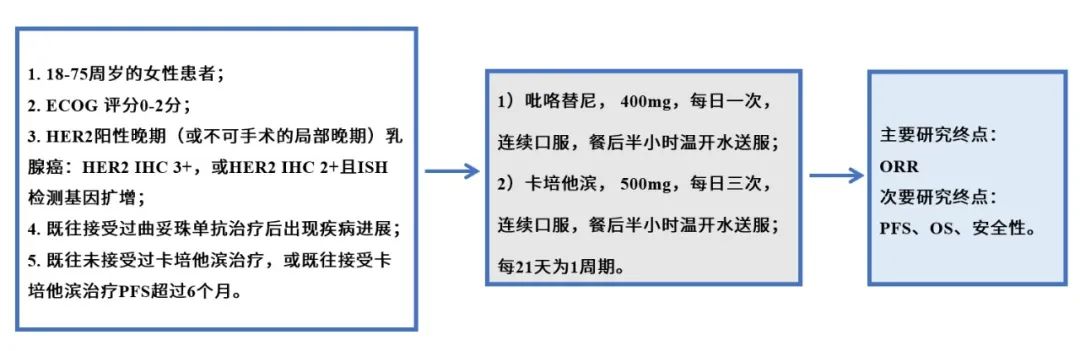
近日,由国家癌症中心提出、赫捷院士牵头起草的《中国女性乳腺癌筛查标准(T/CPMA 014-2020)》正式在线发表于中华预防医学会《中华肿瘤防治杂志》。该标准汇集了国家癌症中心、南京医科大学、天津医科大学肿瘤医院、中国医学科学院肿瘤医院深圳医院、兰州大学、中国医科大学、湖南省肿瘤医院、河北医科大学第四医院、河南省肿瘤医院、四川省肿瘤医院多家单位力量,数十位专家学者参与起草和拟定,为中国女性乳腺癌筛查标准又添新的、更具参考意义的行业准则。现将该标准全文内容展示如下,供读者品鉴。 通信作者:赫捷, 国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院胸外科, Email: hejie@cicams.ac.cn 中国女性乳腺癌筛查标准 本文件规定了乳腺癌筛查过程中筛查人群、筛查措施、筛查要求、筛查结果管理与随访流程、筛查组织管理要求、筛查质量控制与资源库建立及管理的基本原则。 本文件适用于全国各级医疗机构开展乳腺癌筛查。 下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。 GB/T 37864-2019 生物样本库质量和能力通用要求 T/CPMA 002-2019 大型人群队列终点事件长期随访技术规范 T/CPMA 001-2018 大型人群队列研究数据处理技术规范 BI-RADS:乳腺影像报告及数据系统(Breast Imaging Reporting and Data System) DICOM:医学数字成像与通信(Digital Imaging and Communications in Medicine) (一)45~70岁的一般风险人群应进行乳腺癌筛查。乳腺癌一般风险女性即除了乳腺癌高风险人群[定义见以下第(二)部分]以外的所有适龄女性。 (二)高风险人群宜从40岁开始进行乳腺癌筛查,符合下列1、2和3任意条件的女性为乳腺癌高风险人群。 1. 具有遗传家族史,即具备以下任意一项者: (1)一级亲属有乳腺癌或卵巢癌史; (2)二级亲属50岁前,患乳腺癌2人及以上; (3)二级亲属50岁前,患卵巢癌2人及以上; (4)至少1位一级亲属携带已知BRCA1/2基因致病性遗传突变;或自身携带BRCA1/2基因致病性遗传突变。 2. 具备以下任意一项者: (1)月经初潮年龄≤12岁; (2)绝经年龄≥55岁; (3)有乳腺活检史或乳腺良性疾病手术史,或病理证实的乳腺(小叶或导管)不典型增生病史; (4)使用“雌孕激素联合”的激素替代治疗≥6个月; (5)45岁后乳腺X线检查提示乳腺实质(或乳房密度)类型为不均匀致密性或致密性。 3. 具备以下任意两项者: (1)无哺乳史或哺乳时间<4个月; (2)无活产史(含从未生育、流产、死胎)或初次活产年龄≥30岁; (3)仅使用“雌激素”的激素替代治疗≥6个月; (4)流产(含自然流产和人工流产)≥2次。 注1:一级亲属指母亲、女儿以及姐妹。 注2:二级亲属指姑、姨、祖母和外祖母。 一般风险人群的筛查措施为: 1. 每1~2年应进行1次乳腺超声检查; 2. 如不具备乳腺超声检查条件,宜使用乳腺X线摄影检查。 高风险人群的筛查措施为: 1. 每年应进行1次乳腺超声联合乳腺X线摄影检查; 2. 对于不具备乳腺X线摄影检查条件的地区,宜选择乳腺超声进行检查; 3. 对于检测为BRCA1/2突变携带者,宜使用乳腺超声联合乳腺X线摄影进行检查后,加用乳腺核磁检查。 筛查仪器与操作要求应符合附录A的规定。 1. 乳腺X线摄影诊断结果分类 乳腺X线摄影诊断依据宜按附录B对影像诊断结果进行记录、分析。结果诊断依据宜按下列规定进行评估分类: (1) BI-RADS 0:现有影像未能完成评价,需要增加其他影像检查,包括加压点片、加压放大、加拍其他体位,或行超声检查; (2) BI-RADS 1:正常,乳腺X线摄片无异常发现。恶性可能性0; (3) BI-RADS 2:良性发现,存在明确的良性改变,无恶性征象。恶性可能性0; (4) BI-RADS 3:良性可能大的病灶。恶性可能性>0但≤2%; (5) BI-RADS 4:可疑恶性的病灶,但不具备典型的恶性征象。恶性可能性>2%但<95%; ① BI-RADS 4A:低度疑似恶性,恶性可能性>2%但≤10%; ② BI-RADS 4B:中度疑似恶性,恶性可能性>10%但≤50%; ③ BI-RADS 4C:高度疑似恶性,恶性可能性>50%但<95%; (6) BI-RADS 5:高度提示恶性的病灶,有典型乳腺癌的影像学特征,恶性可能性≥95%。 注:附录B为采用美国放射学会(American College of Radiology, ACR)制定并为国际广泛采用的乳腺影像报告及数据系统(BI-RADS)对影像诊断结果进行记录、分析。 2. 乳腺超声诊断结果分类 乳腺超声诊断依据宜按附录B对影像诊断结果进行记录、分析,结果诊断依据宜按下列规定进行评估分类: (1)BI-RADS 0:超声获得的诊断信息不完整,无法评价,需召回患者,建议其行其他影像学检查如乳腺核磁、乳腺X线后再评估; (2)BI-RADS 1:阴性,超声上无异常发现。恶性可能性0; (3)BI-RADS 2:良性病变,存在明确的良性改变,无恶性征象。恶性可能性0; (4)BI-RADS 3:良性可能大的病灶。恶性可能性>0但≤2%; (5)BI-RADS 4:可疑恶性的病灶,但不具备典型的恶性征象。恶性可能性>2%但<95%; ① BI-RADS 4A:低度疑似恶性,恶性可能性>2%但≤10%; ②BI-RADS 4B:中度疑似恶性,恶性可能性>10%但≤50%; ③ BI-RADS 4C:高度疑似恶性,恶性可能性>50%但<95%; (6)BI-RADS 5:高度提示恶性的病灶,有典型乳腺癌的影像学特征。恶性可能性≥95%。 注:附录B超声评估分类参照美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)筛查及美国放射学会(ACR)提出的BI-RADS分类标准。 筛查结果按下列规定进行管理: 1. BI-RADS 1和BI-RADS 2:无需特殊处理; 2. BI-RADS 3:乳腺X线摄影评估为BI-RADS 3,宜在此后6个月时对病灶侧乳腺进行乳腺X线摄影复查,第12个月和24个月时对双侧乳腺进行乳腺X线摄影复查。如果病灶保持稳定,则可继续复查;2~3年随访无变化者可以降为BI-RADS 2,如果复查过程中病灶消失或缩小,可直接评估为BI-RADS 2或 BI-RADS 1。若复查过程中病灶有可疑发现,应考虑活检。乳腺超声评估为BI-RADS 3,宜3~6个月行乳腺超声复查,2年随访无变化者可降为BI-RADS 2; 3. BI-RADS 4A:应进一步影像检查,必要时活检; 4. BI-RADS 4B:应进一步影像检查,宜进行活检; 5. BI-RADS 4C和BI-RADS 5:应进行活检。 随访应符合下列规定: 1. 对筛查结果为BI-RADS 4和BI-RADS 5的受检者,通过电话、家访及医疗机构病案信息调取查阅等方式进行随访,获得每位筛查对象的最终诊断结果与结局信息; 2. 随访质量控制指标见第九章。 1. 所有参加筛查者在自愿的原则下签署知情同意书,签署知情同意前,需要向拟参加筛查的对象说明筛查的相关情况,回答筛查对象的问题。 2. 知情同意书的内容应至少包括: (1)筛查目的; (2)筛查意义; (3)筛查过程; (4)参加筛查可能获得的益处和风险; (5)筛查费用; (6)保密原则和自愿原则; (7)签字及日期。 1. 进行乳腺癌筛查时,应首先通过流行病学问卷调查对人群进行风险评估。问卷内容宜按附录D所列内容进行调查。 2. 风险评估可在医疗机构进行;也可通过信息化技术为居民提供自评服务,并由医疗机构工作人员予以必要的咨询和解答。 3. 负责风险评估的人员应接受权威机构组织的乳腺癌筛查相关专业知识培训后上岗。 1. 承担乳腺癌筛查的医疗机构要求 (1)具有乳腺癌筛查、诊断和(或)治疗能力; (2)乳腺超声及乳腺X线摄影仪器符合筛查要求,并定期由专人维护与校准。 2. 筛查工作人员要求 应由多学科人员共同合作,应包括流行病学、影像科、乳腺外科、肿瘤科、检验科和病理科等筛查相关学科医师及工作人员;同时应配备人员对筛查对象的随访复查结果进行跟踪,并将信息录入到计算机数据库和存档。 3. 筛查诊断与操作工作人员要求 诊断与操作工作人员应符合下列规定: (1)乳腺超声诊断医师:初查由超声专业工作满5年以上或高年资主治医师(3年以上)进行,如遇到阳性病例应由副高级及以上职称医师复审; (2)乳腺X线摄影操作技师: ① 经过专业技术培训,取得乳腺X线摄影操作技师上岗证(国家或当地卫生健康委员会颁发); ② 具有2年以上乳腺X线摄影工作经验,固定从事乳腺X线摄影工作者优先。 (3)乳腺X线摄影诊断医师: ① 具有5年以上乳腺X线摄影诊断工作经验; ② 如采取双阅片诊断模式,其中1名应为副高级及以上职称或专职工作3年以上的主治医师。 筛查设备应符合下列规定: 1. 乳腺X线摄影:乳腺X线摄影机(诊疗许可证校验合格),见附录A; 2. 乳腺超声:具备彩色超声诊断仪(高频线阵探头),见附录A。 筛查质量控制应符合下列规定: 1. 风险评估、检查诊断及结果管理的工作人员应具备所需的工作资质和工作背景; 2. 定期由影像专业副高级及以上职称医师对筛查出的乳腺癌BI-RADS 4以上影像采取100%复阅,对其他采取1%抽检; 3. 乳腺X线摄影设备,应每年由有医疗设备检测资质的部门按行业标准进行状态检测,并取得合格证; 4. 硬拷贝成像相机、自动洗片机、增感屏、胶片及数字图像软阅读及阅读环境,应按设备质量评估程序进行质量管理; 5. 随访的质量控制宜参考T/CPMA 002-2019中的第七部分“质量控制与评价”。 有条件的地区,宜建立乳腺癌筛查资源库,应包含筛查数据库、影像资料库和生物样本库。宜按以下要求建立: 1. 筛查数据库应包括风险评估数据、乳腺癌筛查数据、临床诊疗数据和随访数据。数据的类型和隐私保护宜参考T/CPMA 001-2018中的第四部分“大型队列研究数据隐私保护”; 2. 应包括乳腺超声和(或)乳腺X线摄影的图像,乳腺超声提供DICOM和JPG格式的所有图像,乳腺X线摄影提供DICOM格式双侧共4张图像; 3. 对于参加筛查者,宜采集和存储血液样本;BI-RADS 4和BI-RADS 5需要活检者,应在有活检条件的医疗机构进行活检,并存储组织样本等。生物样本的采集、运输和存储宜参考GB/T 37864-2019中的要求。 (规范性) 乳腺X线摄影 (一)乳腺X线摄影机(诊疗许可证校验合格) 1. 乳腺X线摄影:数字采集成像系统(50 μm像素CR/DR)+乳腺X线摄影专用激光打印系统; 2. 可调亮度、带遮幅装置的高亮度观片灯(最高亮度≥3 000 cd/m2),CR/DR软阅读/3~5 M竖屏; 3. 成像质量检测相关乳腺模体。 (二)操作要求 1. 照射前准备 照射前应向接受检查者仔细说明照射过程中涉及步骤及环节,要求受检者予以配合。 2. 照射体位 常规投照体位为双侧内外侧斜位(mediolateral oblique, MLO位)及头尾位(craniocaudal, CC位),MLO位片和CC位片应符合下列规定: (1)MLO位片显示为:乳房被推向前上,乳腺实质充分展开,胸大肌可见,较松弛,下缘达乳头水平,乳头在切线位,部分腹壁包括在片中,但与下部乳腺分开,绝大部分乳腺实质显示在片中; (2)CC位片显示为:乳房在片子的中央,乳头在切线位,小部分胸大肌可见,应包含全部内象限,外侧乳腺组织大部分显示,可能少部分不能包括在图像中。 3. 补充投照体位和投照技术 对于MLO位及CC位显示不良或未包全的乳腺实质,可以根据病灶位置的不同选择:外内侧(lateromedial, LM)位、内外侧(mediolateral, ML)位、内侧头尾(medial craniocaudal, MCC)位、外侧头尾(lateral craniocaudal, LCC)位及乳沟位进行补充。可进一步采用特殊摄影技术评价在上述常规摄影中显示出的异常改变。可在任何投照位上进行局部加压摄影、放大摄影或局部加压放大摄影,进一步显示病灶和明确病变性质。 (一)设备要求 1. 具备彩色超声诊断仪(高频线阵探头),探头频率为7.5~12.0 MHz,有条件时可用到15.0 MHz,但对于乳腺组织过厚或有假体时,可适当降低探头频率。 2. 超声探头和频率的选择原则是在保证足够探查深度的前提下,尽量提高频率,保证超声图像的分辨率。 (二)操作要求 操作要求如下: 1. 检查部分及方式: (1)检查时患侧手臂尽量上抬外展,充分暴露乳房及腋下,探头直接放在乳房表面,对乳头、乳晕及乳房外上、外下、内上、内下4个象限进行全面扫查,次序可由操作者自行确定; (2)扫查方式包括放射状、反放射状、旋转式和平行移动等,可根据接受检查者的习惯选择。检查范围应全面,不应漏检,同时应检查腋下淋巴结情况。 2. 检查内容及测量方式: (1)检查时应先对乳腺及周围组织进行全面的常规二维超声检查,然后对发现病灶的区域进行重点的二维超声检查,检查的内容包括:病灶的位置、大小或范围的测定,边界、边缘、形状、内部及后方回声、钙化和周围组织包括皮肤,胸肌及韧带等结构的变化等。病灶的大小或范围的测量应选取其最大平面,测量两条互相垂直的最长径线,然后在与此切面垂直的最大平面上测量第三个径线; (2)测量时,游标应该放置在病灶边缘的外侧,病灶边界清晰时按照边界测量,肿块边界模糊时,应该根据肿块的最大边缘部分或周边的声晕测量。在二维声像图的基础上应辅助彩色及能量多普勒超声检查,观察彩色血流的走向及分布并在多普勒频谱上测量各种血流参数。在具备条件的情况下,可采用三维重建成像、弹性成像和造影增强对比成像等技术,观察病灶和乳腺组织的硬度变化、空间关系和血管分布,了解病灶和组织的质地变化和血流灌注情况。 (资料性) 影像诊断依据 一、 乳腺影像诊断相关定义 (一)乳腺实质(或称乳房密度)类型 乳腺实质类型分为: 1. 脂肪型; 2. 散在纤维腺体型; 3. 不均匀致密型(可能掩盖小肿块); 4. 致密型(降低乳腺癌检出的敏感性)。 (二)异常征象 异常征象有肿块、钙化、结构扭曲、不对称、乳腺内淋巴结、皮肤病变、单侧扩张的导管及伴随征象。 1. 肿块 肿块为在两个不同投照位置均可见的占位性病变,按下列内容进行描述。 (1)形状:圆形、卵圆形、不规则形; (2)边缘: ① 清晰:至少75%的肿块边界与周围正常组织分界清晰、锐利,其余部分边缘可被周围腺体遮盖,但无浸润或毛刺征象。若任何边缘有浸润或毛刺的肿块,应判断为下述④或⑤; ② 遮蔽状:肿块被重叠或邻近的正常组织遮盖,无法对其作进一步判断,阅片医师认为这个肿块的边界是清晰的,只是被周围腺体遮盖; ③ 微小分叶:边缘呈小波浪状改变; ④ 浸润:病灶本身向周围浸润而引起的边界不规则,而不是由于周围腺体遮盖所致; ⑤ 毛刺:从肿块边缘发出的放射状线影。 (3)密度:与肿块周围相同体积的乳腺组织相比较,可分为高密度、等密度、低密度(不含脂肪)和含脂肪密度。 2. 钙化 钙化的形态和分布描述为: (1)形态: ① 典型良性钙化:包括:皮肤钙化、血管钙化、粗大或爆米花样钙化、大杆状钙化、圆形钙化、环形钙化、营养不良性钙化、钙乳的钙化和缝线钙化等; ② 可疑形态钙化:包括不定形或模糊不清的钙化、粗大不均质钙化、细小多形性钙化(直径常<0.5 mm)、细线样或细线分支样钙化;后者常提示被乳腺癌侵犯的导管腔内钙化。 (2)典型良性钙化不用描述其分布,可疑钙化的分布描述为: ① 弥漫分布; ② 区域性分布:较大范围内分布的钙化,不符合导管分布,常>2 cm2,这种钙化分布的性质应结合形态综合考虑; ③ 簇群分布:指至少有5枚钙化占据较少的范围内(<1 cm2),更多钙化成堆聚集,范围在2 cm2; ④ 线样分布:钙化排列成线状,位于导管内; ⑤ 段样分布:源于一个导管及其分支。 3. 结构扭曲 正常结构被扭曲但无明确的肿块可见,包括从一点发出的放射状影和局灶性收缩,或者在实质的边缘扭曲。 4. 不对称 不对称征象按下列内容进行描述: (1)结构不对称:仅在一个投照位置上可见的纤维腺体组织,大部分是正常腺体组织的重叠所致; (2)整体不对称:较大范围腺体的不对称,至少达1个象限,不伴有其他征象,多为正常变异。但当与临床触及的异常相吻合时,则可能有意义; (3)局灶性不对称:两个投照位置均显示且表现相仿,但缺少真性肿块特有的外凸边缘改变,常为内凹,较球形不对称范围小。它可能代表的是1个正常的腺体岛(尤其当其中含有脂肪时)。但在缺乏特征性的良性征象时,往往需要对其做进一步检查,由此可能会显示1个真性肿块或明显的结构扭曲改变; (4)进展性不对称:新发、增大的或比以前更明显的局灶性不对称。 5. 乳腺内淋巴结 乳腺内淋巴结典型表现为肾形,肉眼可见淋巴结门脂肪所致的透亮切迹,常<1 cm。当淋巴结较大,但其大部分为脂肪替代时,仍为良性改变。可以是多个,也可能是1枚淋巴结由于明显的脂肪替代看上去像多个圆形结节影。对于乳腺外上部的特征性改变可以作出正确诊断。偶尔也可出现在其他区域,多与静脉伴行。 6. 皮肤病变 皮肤病变投照在乳腺组织内,尤其是两个投照体位都有显示的时候,应在评估报告中提及。摄片的技术员应在皮肤病变处放一个不透X线的标志。 7. 单侧扩张的导管 管状或分支样结构可能代表扩张或增粗的导管。 8. 相关伴随征象 (三)病灶部位 病灶描述为: 1. 部位:注明左侧和(或)右侧; 2. 象限及钟面标明:外上象限、内上象限、外下象限、内下象限、乳晕下、中央区、腋尾; 3. 深度:自乳头向后,用前、中、后1/3描述深度; 4. 注明病灶距乳头的距离。 乳腺X线摄影的诊断评估分类应符合表1的规定。 乳腺超声的诊断评估分类应符合表2的规定。 附录C (资料性) 乳腺癌筛查流程 图C.1给出了乳腺癌筛查流程。 附录D (资料性) 乳腺癌风险评估问卷 以下为乳腺癌风险评估可参考内容。引言
范围
规范性引用文件
缩略语
筛查人群
筛查措施
(一)一般风险人群
(二)高风险人群
筛查检查要求与结果分类
(一)检查要求
(二)诊断结果分类
结果管理与随访流程
(一)结果管理
(二)随访流程
筛查组织管理要求
(一)筛查流程图(参见附录C)
(二)知情同意的程序
(三)风险评估场所及工作人员要求
(四)筛查医疗机构及工作人员要求
(五)筛查设备要求
质量控制
乳腺癌筛查资源库建立及管理
附录A
筛查仪器与操作要求
乳腺超声
附录B
乳腺X线摄影诊断评估分类

乳腺超声诊断评估分类